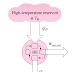
Termodinamika (bahasa Yunani: thermos = 'panas' and dynamic = 'perubahan') adalah fisika energi , panas, kerja, entropi dan kespontanan proses. Termodinamika
berhubungan dekat dengan mekanika statistik di mana hubungan termodinamika
berasal.
Pada sistem di mana terjadi proses
perubahan wujud atau pertukaran energi, termodinamika klasik tidak berhubungan
dengan kinetika reaksi(kecepatan
suatu proses reaksi berlangsung). Karena alasan ini, penggunaan istilah
"termodinamika" biasanya merujuk pada termodinamika setimbang. Dengan
hubungan ini, konsep utama dalam termodinamika adalah proses kuasistatik, yang
diidealkan, proses "super pelan". Proses termodinamika
bergantung-waktu dipelajari dalamtermodinamika
tak-setimbang.
Karena termodinamika tidak
berhubungan dengan konsep waktu, telah diusulkan
bahwa termodinamika setimbang seharusnya dinamakan termostatik.
Hukum termodinamika kebenarannya
sangat umum, dan hukum-hukum ini tidak bergantung kepada rincian dari interaksi
atau sistem yang diteliti. Ini berarti mereka dapat diterapkan ke sistem di
mana seseorang tidak tahu apa pun kecual perimbangan transfer energi dan wujud
di antara mereka dan lingkungan. Contohnya termasuk perkiraan Einstein tentang emisi spontan dalam abad ke-20 dan riset sekarang ini tentang termodinamika
benda hitam.
Menurut Arief MS Termodinamika
adalah suatu konsep mekanika perpindahan Energi. Seperti panas, dimana konsep
perpindahan panas adalah panas secara spontan akan berpindah dari temperatur
tinggi ke temperatur rendah.
Ada beberapa pengertian dari
Termodinamika:
·
Termodinamika adalah cabang ilmu
fisika yang mempelajari pertukaran energi dalam bentuk kalor dan kerja, sistem
pembatas (boundary) serta lingkungan.
·
Termodinamika adalah ilmu yang
mempelajari hubungan antara panas, kerja mekanik serta aspek-aspek lain dari
energi dan perpindahannya.
·
Termodinamika adalah suatu cabang
ilmu fisika yang mempelajari hokum-hukum dasr yang dipatuhi oleh kalor dan usaha.
Termodinamika
adalah bidang ilmu yang meliputi hubungan antara panas dan jenis energi
lainnya. Termodinamika ditemukan dan diteliti awal tahun 1800-an. Pada saat
itu, itu terkait dengan dan mendapat perhatian karena penggunaan mesin uap.
Termodinamika
dapat dipecah menjadi empat hukum. Meskipun ditambahkan ke dalam hukum
termodinamika setelah tiga hukum lainnya, hukum ke nol biasanya dibahas
terlebih dahulu. Ini menyatakan bahwa jika dua sistem berada dalam
kesetimbangan termal dengan sistem ketiga, maka mereka berada dalam
kesetimbangan termal satu sama lain. Dengan kata lain, jika dua sistem adalah
temperatur yang sama sebagai sistem yang ketiga, maka ketiganya adalah suhu
yang sama.
Hukum
pertama termodinamika menyatakan bahwa energi total sistem tetap konstan,
bahkan jika itu diubah dari satu bentuk ke bentuk lainnya. Misalnya, energi
kinetik – energi yang memiliki obyek ketika bergerak – diubah menjadi energi
panas ketika sopir menekan rem pada mobil untuk memperlambatnya. Ada sering menangkap
frase untuk membantu orang mengingat hukum pertama termodinamika: “Usaha adalah
kalor, dan kalor adalah usaha.” Pada dasarnya, usaha dan panas yang setara.
Hukum kedua
termodinamika adalah salah satu hukum yang paling dasar dalam ilmu pengetahuan.
Ini menyatakan bahwa panas tidak bisa mengalir ke sistem pada suhu yang lebih
tinggi dari sistem pada suhu yang lebih rendah dengan kemauan sendiri. Untuk
tindakan tersebut terjadi, usaha harus dilakukan. Jika es batu ditempatkan
dalam secangkir air hangat, es batu mencair saat panas air mengalir ke
dalamnya. Hasil akhirnya adalah secangkir air yang sedikit dingin. Es batu
hanya bisa terbentuk jika menggunakan energi.
Contoh lain
dari hukum kedua hanya bekerja dengan penambahan energi dapat dilihat dengan kulkas
tua. Dalam hal ini, pendinginan dari dalam kulkas menghangatkan di luar itu.
Jadi, usaha yang dilakukan dan usaha membuat kalor. Usaha selesai dengan pompa
kulkas.
Hukum kedua
termodinamika juga mengatakan bahwa hal-hal dapat aus. Sebagai contoh, jika
sebuah rumah bata dibiarkan tidak terawat, akhirnya akan runtuh karena angin,
hujan, dingin, dan kondisi cuaca lainnya. Namun, jika tumpukan batu bata jika
dibiarkan tanpa pengawasan, tidak akan pernah membentuk sebuah rumah, kecuali
usaha akan ditambahkan ke dalam campuran.
Hukum ketiga
termodinamika menyatakan bahwa perubahan entropi dari suatu sistem ketika
mengubah dari satu bentuk ke bentuk lainnya mendekati nol suhunya mendekati nol
pada skala Kelvin. Nol pada skala Kelvin adalah mutlak batas bawah suhu –
ketika atom dan molekul memiliki energi paling mungkin. Entropi didefinisikan
sebagai ketersediaan energi sistem untuk melakukan pekerjaan. Jadi, berikut
bahwa ada skala absolut entropi. Akibatnya, tidak ada sistem nyata yang bisa
mencapai nol derajat pada skala Kelvin.
 merupakan indeks adiabatik atau rasio kapasitas panas. Beberapa sumber
menggunakan huruf k.
merupakan indeks adiabatik atau rasio kapasitas panas. Beberapa sumber
menggunakan huruf k. adalah
adalah  untuk
gas diatomik seperti udara dan
untuk
gas diatomik seperti udara dan  untuk gas monoatomik seperti gas mulia. Rumus untuk
panas spesifik menjadi (untuk kasus tertentu saja):
untuk gas monoatomik seperti gas mulia. Rumus untuk
panas spesifik menjadi (untuk kasus tertentu saja): adalah
adalah  untuk
gas diatomik seperti udara dan
untuk
gas diatomik seperti udara dan  untuk gas monoatomik seperti gas mulia. Rumus untuk
panas spesifik menjadi (untuk kasus tertentu saja):
untuk gas monoatomik seperti gas mulia. Rumus untuk
panas spesifik menjadi (untuk kasus tertentu saja):